Indice dei Contenuti
- Sintesi Esecutiva: Lo Stato dell’Ingegneria dei Dispositivi di Xenotrapianto Rena in 2025
- Driving di Mercato e Barriere: Prospettive Regolatorie, Etiche e Cliniche
- Attori Chiave e Innovatori: Panoramiche sulle Aziende e Iniziative Strategiche
- Tecnologie Fondamentali: Bioingegneria, Immunoprotezione e Integrazione dei Dispositivi
- Sperimentazioni Cliniche e Milestone: Risultati Recenti e Progresso della Pipeline
- Sfide e Soluzioni di Manifattura: Materiali, Scalabilità e QA
- Panorama Normativo: FDA, EMA e Approvazioni Internazionali in Evidenza
- Previsioni di Mercato 2025–2030: Proiezioni di Crescita e Punti Caldi di Opportunità
- Panorama Competitivo: Partnership, M&A e Trend di Proprietà Intellettuale
- Il Futuro dei Dispositivi di Xenotrapianto Renale: Roadmap, Rischi e Innovazioni Emergenti
- Fonti & Riferimenti
Sintesi Esecutiva: Lo Stato dell’Ingegneria dei Dispositivi di Xenotrapianto Rena in 2025
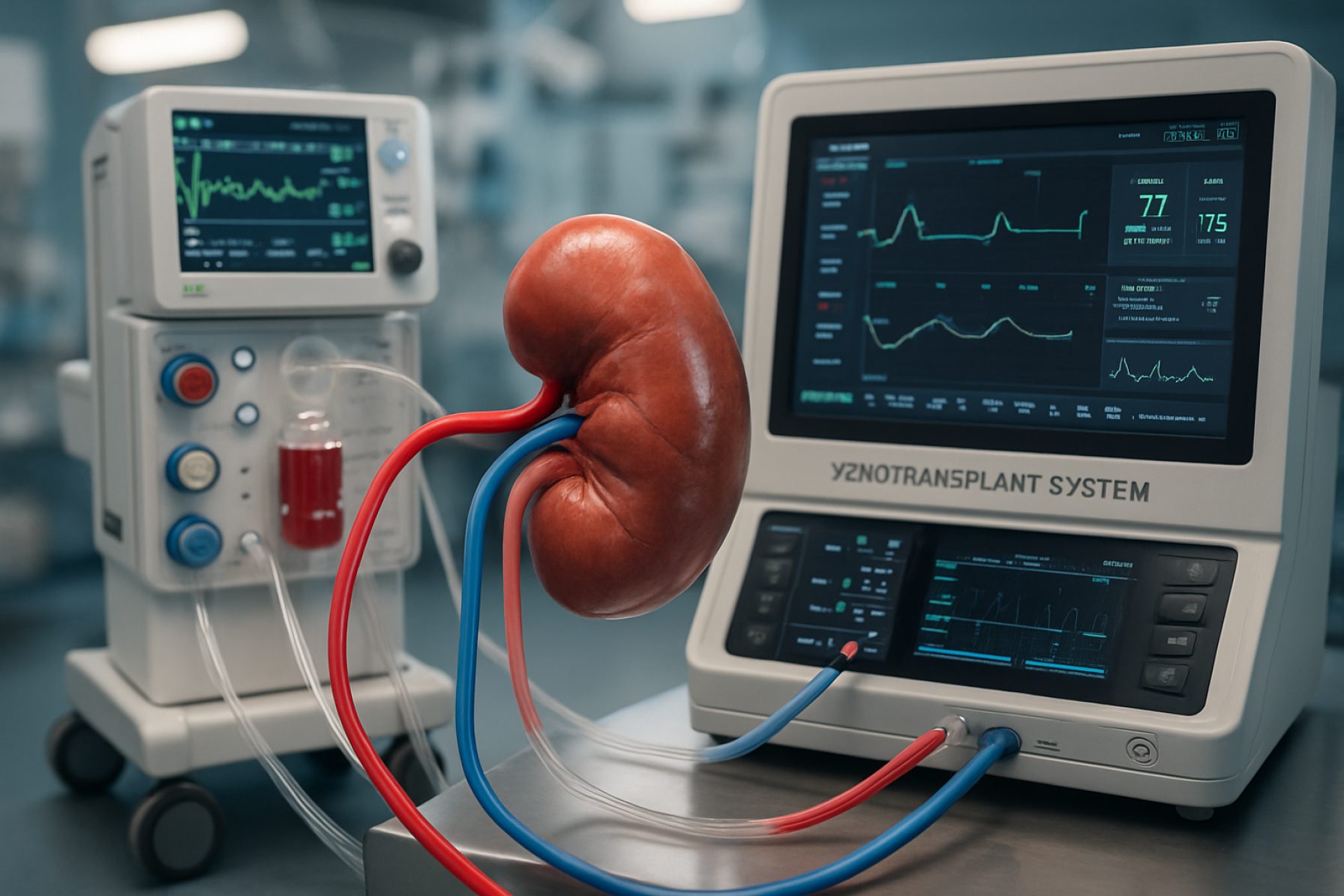
L’ingegneria dei dispositivi di xenotrapianto renale, a partire dal 2025, si colloca all’incrocio tra design di organi sintetici, tecnologie avanzate di immunomodulazione e piattaforme di organi porcini modificati geneticamente. Il settore ha visto un progresso accelerato grazie a carenze critiche di organi donatori umani e crescenti investimenti in soluzioni bioingegnerizzate scalabili. Attori chiave sono entrati in fasi precliniche avanzate e in fase clinica iniziale, con le prove “first-in-human” che segnano un anno fondamentale per l’industria.
Un principale obiettivo nel 2025 è l’ingegneria di dispositivi extracorporei e impiantabili capaci di colmare o sostituire la funzione renale, sia come passo verso che in concomitanza con i reni xenotrapiantati. Aziende come OrganOx e Nuwellis stanno sviluppando sistemi di perfusione e supporto in grado di mantenere la vitalità degli xenograft ex vivo e aiutare a modulare le risposte immunitarie dei riceventi. Questi dispositivi sono in fase di affinamento per consentire una conservazione prolungata, valutazione della vitalità e immunoadsorbimento selettivo, tutti essenziali sia per il trapianto che per la gestione post-trapianto.
Parallelamente, l’ingegneria dei dispositivi è strettamente integrata con lo sviluppo di reni porcini modificati geneticamente. Aziende come Universal Cells (una sussidiaria di Astellas Pharma) ed elegen stanno collaborando con aziende di bioingegneria per garantire la compatibilità tra organi e dispositivi di supporto. È importante notare che il primo xenotrapianto di rene porcino modificato geneticamente in un essere umano vivente, effettuato nel 2024 utilizzando un protocollo assistito da dispositivo, ha dimostrato una funzione sostenuta per oltre un mese, evidenziando le promesse e le sfide dell’integrazione dispositivo-tessuto.
Sul fronte immunologico, i produttori di dispositivi stanno innovando tecnologie di filtrazione e adsorbimento progettate per catturare anticorpi xenoreattivi e modulare l’attivazione del complemento. Aziende come Fresenius Medical Care stanno adattando piattaforme di emodialisi e immunoadsorbimento specificamente per applicazioni di xenotrapianto, con l’obiettivo di ridurre i tassi di rigetto iperacuto e prolungare la sopravvivenza del trapianto. L’integrazione di biosensori in tempo reale in questi dispositivi consente una pronta identificazione del rigetto o dell’infezione, consentendo un intervento clinico tempestivo.
Guardando al futuro, i prossimi anni dovrebbero portare traguardi normativi e sperimentazioni cliniche ampliate, con la FDA statunitense e l’Agenzia Europea dei Medicinali che collaborano attivamente con i produttori per stabilire standard di sicurezza ed efficacia per i dispositivi. Partnership strategiche tra ingegneri di dispositivi, aziende biotech e centri accademici di trapianto stanno accelerando i miglioramenti iterativi sia negli hardware che negli interfacci biologici. Entro il 2027, gli esperti prevedono l’emergere dei primi dispositivi di supporto renale specifici per xenotrapianto disponibili commercialmente, aprendo la strada a un’adozione clinica più ampia e stabilendo un nuovo paradigma nella terapia di sostituzione degli organi.
Driving di Mercato e Barriere: Prospettive Regolatorie, Etiche e Cliniche
Il panorama dell’ingegneria dei dispositivi di xenotrapianto renale è plasmato da un complesso intreccio di fattori regolatori, etici e clinici mentre il settore avanza verso la traduzione clinica nel 2025 e negli anni immediatamente successivi. La carenza critica di reni donatori umani in tutto il mondo continua a guidare innovazione e investimenti, rendendo il xenotrapianto—un processo che comporta il trapianto di organi provenienti da altre specie, principalmente suini geneticamente modificati—un’area di significativo interesse.
Da un punto di vista regolatorio, autorità come la Food and Drug Administration (FDA) degli Stati Uniti stanno stabilendo quadri per valutare la sicurezza e l’efficacia dei dispositivi e delle procedure di xenotrapianto. Nel 2024, la FDA ha concesso la designazione di breakthrough a diversi dispositivi di xenotrapianto investigational, accelerando la loro revisione e segnalando una crescente apertura a queste innovazioni. Tuttavia, i processi di approvazione regolamentare rimangono rigorosi, richiedendo dati preclinici e clinici completi per affrontare rischi unici come l’infezione zoonotica, il rigetto immunitario e la vitalità a lungo termine del trapianto.
Le considerazioni etiche sono al centro dell’ingegneria dei dispositivi per il xenotrapianto. I comitati di revisione istituzionali e i comitati etici, spesso guidati da organizzazioni come il World Health Organization (OMS), stanno esaminando i protocolli per garantire il benessere degli animali, il consenso informato e l’accesso equo. La recente emersione di strategie di comunicazione trasparente da parte degli sviluppatori di dispositivi e delle aziende di ingegneria degli organi sottolinea l’enfasi sulla fiducia pubblica e sull’accettazione sociale. Aziende come elegen e eGenesis stanno implementando tecnologie avanzate di editing genetico per ridurre il rischio di rigetto immunitario e trasmissione di malattie tra specie, dimostrando un impegno proattivo sia verso imperativi scientifici che etici.
Cliniamente, le principali barriere sono la compatibilità immunologica, l’integrazione perioperatoria dei dispositivi e la gestione delle complicazioni post-trapianto. Ingegnerizzare dispositivi che facilitino la conservazione, il trasporto e l’anastomosi vascolare in modo sicuro è una priorità. Produttori come Xenothera stanno sviluppando agenti immunomodulatori e sistemi di consegna specificamente adattati per i protocolli di xenotrapianto. Sono attese, nelle sperimentazioni cliniche fase iniziale del 2024-2025, dati critici sulle prestazioni dei dispositivi, sulla sicurezza dei pazienti e sulla funzionalità del trapianto, che informeranno la prossima iterazione delle linee guida regolatorie e cliniche.
Guardando al futuro, le prospettive di mercato per l’ingegneria dei dispositivi di xenotrapianto renale sono prudentemente ottimistiche. Le agenzie regolatorie stanno attivamente affinando i percorsi di approvazione, mentre i corpi etici e le reti cliniche stanno lavorando per standardizzare le migliori pratiche. Man mano che le prestazioni e i profili di sicurezza dei dispositivi migliorano, il settore è posizionato per un’adozione incrementale, a condizione di una collaborazione continua tra industria, regolatori e comunità medica per affrontare le sfide emergenti e l’accettazione pubblica.
Attori Chiave e Innovatori: Panoramiche sulle Aziende e Iniziative Strategiche
Il settore dell’ingegneria dei dispositivi di xenotrapianto renale sta vivendo una crescita dinamica nel 2025, caratterizzata da iniziative strategiche di un gruppo selezionato di aziende pionieristiche. Queste organizzazioni stanno spingendo i confini della biotecnologia, dell’ingegneria bio e dell’integrazione dei dispositivi medici per affrontare le crisi della malattia renale cronica e della carenza di organi. Negli ultimi anni si è assistito a una convergenza di ingegneria genetica, sviluppo di dispositivi immunomodulatori e soluzioni di produzione scalabili, con diversi attori chiave che stanno emergendo in prima linea.
- eGenesis è un leader nello sviluppo di organi porcini modificati geneticamente. Nel 2025, continua a far progredire il suo portafoglio di reni ingegnerizzati, concentrandosi sulla riduzione dell’immunogenicità attraverso modifiche basate su CRISPR. Le partnership strategiche dell’azienda con ingegneri di dispositivi stanno producendo sistemi di perfusione adattati per il trapianto porcine-to-human, mirando a ottimizzare la vitalità degli organi durante il trasporto e l’impianto (eGenesis).
- United Therapeutics e la sua controllata interamente posseduta, Revivicor, rimangono fondamentali nel settore. Revivicor fornisce sia porci geneticamente modificati che collabora per sviluppare dispositivi per la conservazione ex vivo degli organi. Le loro iniziative nel 2025 includono il perfezionamento di piattaforme di perfusione automatizzata che mantengono condizioni fisiologiche e minimizzano il danno ischemico, in preparazione per il dispiegamento clinico dei xenoreni (United Therapeutics).
- XVIVO Perfusion è specializzata in tecnologie di conservazione degli organi e sta espandendo il suo portafoglio per supportare applicazioni di xenotrapianto. Nel 2025, XVIVO sta avanzando sistemi di perfusione a macchina normotermica adattati alle esigenze uniche dei reni porcini, migliorando i protocolli di valutazione e condizionamento per migliorare i risultati post-trapianto (XVIVO Perfusion).
- OrganOx, rinomata per i suoi dispositivi di perfusione normotermica nello spazio del trapianto allogenico, ha avviato collaborazioni mirate a sperimentazioni di xenotrapianto. Le loro adattazioni dei dispositivi nel 2025 si concentrano sulle sfide metaboliche e immunologiche degli organi porcini, cercando di dimostrare sicurezza ed efficacia in ambienti preclinici e clinici iniziali (OrganOx).
- Qihan Biotech sta sfruttando l’editing genico multiplo nei suini ed esplorando lo sviluppo di dispositivi sinergici per supportare la traduzione clinica. Le loro partenariati strategici nel 2025 mirano a integrare sistemi di monitoraggio in tempo reale e caratteristiche di biocontenimento nei dispositivi di conservazione renale (Qihan Biotech).
Guardando avanti, si prevede che questi attori accelereranno la validazione clinica, il coinvolgimento normativo e la produzione scalabile. I prossimi anni vedranno probabilmente rapide iterazioni nel design dei dispositivi, insieme a un aumento delle collaborazioni tra aziende di bioingegneria e produttori di dispositivi medici, con l’obiettivo di rendere il xenotrapianto renale una realtà di routine.
Tecnologie Fondamentali: Bioingegneria, Immunoprotezione e Integrazione dei Dispositivi
L’ingegneria dei dispositivi di xenotrapianto renale si trova all’incrocio dell’innovazione bioingegneristica, della modulazione immunologica e dell’integrazione avanzata di sistemi biologici e meccanici. A partire dal 2025, il settore sta vivendo un rapido progresso, guidato dalla domanda urgente di alternative agli organi donatori umani e da un pipeline tecnologica in maturazione.
Al centro degli ultimi progressi c’è lo sviluppo di reni porcini bioingegnerizzati, modificati geneticamente per mitigare il rigetto iperacuto. Aziende come Eledon Pharmaceuticals ed eGenesis stanno ingegnerizzando porci donatori con modifiche genetiche mirate—rimuovendo xenoantigeni chiave e incorporando proteine regolatorie umane—riducendo sostanzialmente il rischio di risposta immunitaria immediata e disfunzione della coagulazione. Nel 2024-2025, questi sforzi hanno portato a studi preclinici di successo e trapianti di uso compassionevole in fase iniziale, dimostrando perfusione sostenuta e funzionalità renale in modelli di primati non umani per diversi mesi, un traguardo che era sfuggente solo pochi anni prima.
L’immunoprotezione rimane una sfida fondamentale. Per affrontarla, l’ingegneria dei dispositivi ha adottato approcci ibridi che combinano tecnologie di incapsulamento cellulare e rilascio locale di immunosoppressori. Ad esempio, Tandem Bio sta avanzando prototipi di reni bioartificiali che integrano membrane selettivamente permeabili, consentendo lo scambio metabolico proteggendo fisicamente i tessuti xenogenici dalle cellule immunitarie ospiti. Nel frattempo, BioConnect sta sviluppando dispositivi impiantabili dotati di sistemi microfluidici per monitoraggio in tempo reale e rilascio controllato di immunosoppressori, mirati a minimizzare l’esposizione sistemica ai farmaci e i rischi associati.
L’integrazione dei dispositivi è un altro fronte attivo. Sistemi di perfusione extracorporea modulari—come quelli pionieristici di OrganOx—stanno venendo adattati per tessuti xenogenici, supportando la valutazione della vitalità e il condizionamento dei reni porcini prima del trapianto. Parallelamente, dispositivi di artificiale renale indossabili e completamente impiantabili, come quelli in fase di sviluppo da parte di Renal Therapeutics, sono progettati per la futura compatibilità con i protocolli di xenotrapianto.
In prospettiva, i prossimi anni dovrebbero assistere alla transizione di queste tecnologie da un affinamento preclinico a prove cliniche di prima applicazione sull’uomo. Le agenzie regolatorie come la Food and Drug Administration (FDA) stanno attivamente coinvolgendo gli stakeholder per definire percorsi sicuri per le approvazioni dei dispositivi di xenotrapianto. La continua integrazione di biosensori in tempo reale, modulazione immunitaria automatizzata e bioprinting avanzato accelererà probabilmente l’emergere di soluzioni di xenotrapianto commercialmente valide e scalabili entro la fine del 2020.
Sperimentazioni Cliniche e Milestone: Risultati Recenti e Progresso della Pipeline
Il campo dell’ingegneria dei dispositivi di xenotrapianto renale ha testimoniato progressi notevoli nella traduzione clinica negli ultimi anni, con il 2025 che segna diversi milestone fondamentali. L’integrazione di dispositivi bioingegnerizzati, come sistemi di perfusione extracorporea e tecnologie di incapsulamento immunoprotettivo, è diventata centrale sia per studi preclinici che per le emergenti prove umane.
Uno dei progressi più notevoli è stato l’uso di dispositivi di perfusione specificamente adattati per il trapianto di reni da suini a umani. All’inizio del 2024, l’International Xenotransplantation Association ha evidenziato l’implementazione di sistemi di perfusione a macchina normotermica (NMP) che mantengono i reni porcini in uno stato vitale prima dell’impianto. Questi sistemi, sviluppati in collaborazione con produttori di dispositivi e laboratori accademici, hanno dimostrato la capacità di ridurre il danno ischemico e ottimizzare la funzionalità dell’organo durante la finestra critica pre-trapianto.
Un significativo milestone clinico è stato raggiunto nel 2024 quando NYU Langone Health ha riportato la prima sopravvivenza estesa (oltre 60 giorni) di un rene di un maiale modificato geneticamente in un ricevente umano, utilizzando una combinazione di tecnologia di perfusione avanzata e interventi immunoprotettivi. Il dispositivo di perfusione, fornito da un’importante azienda di ingegneria biomedica, ha fornito ossigenazione continua e consegna di nutrienti, mentre sensori di monitoraggio in tempo reale hanno misurato la qualità della perfusione e i marcatori metabolici. Questo risultato ha aperto la strada per espandere le prove di uso compassionevole nel 2025.
Parallelamente alle piattaforme di perfusione, lo sviluppo di dispositivi di immunoisolamento—come sistemi di microincapsulamento e macroincapsulamento—ha accelerato. Questi dispositivi mirano a proteggere i tessuti xenogenici dal sistema immunitario dell’ospite, minimizzando o eliminando la necessità di immunosoppressione sistemica. Aziende come Sigilon Therapeutics hanno creato materiali di incapsulamento con migliorata biocompatibilità e permeabilità, attualmente in fase di validazione preclinica e discussioni normative in fase iniziale.
Guardando al futuro, la pipeline include l’affinamento delle tecnologie di biosensori impiantabili per il monitoraggio in tempo reale del trapianto, così come sistemi di perfusione “intelligenti” in grado di adeguare dinamicamente la composizione del perfusato in base alla domanda metabolica dell’organo. Ci si aspetta che la collaborazione tra produttori di dispositivi, centri di trapianto e enti regolatori intensifichi, con la FDA americana che segnala apertura a percorsi accelerati per dispositivi innovativi nel xenotrapianto (U.S. Food & Drug Administration).
Entro il 2026 e oltre, si prevede che le sperimentazioni cliniche incorporeranno sempre più questi dispositivi ingegnerizzati, con studi multicentrici che valuteranno non solo la sopravvivenza del trapianto ma anche l’integrazione funzionale e i risultati per i pazienti. Questi sforzi sono destinati a stabilire fermamente l’ingegneria dei dispositivi come un pilastro di xenotrapianto renale sicuro ed efficace.
Sfide e Soluzioni di Manifattura: Materiali, Scalabilità e QA
La produzione di dispositivi di xenotrapianto renale nel 2025 affronta un insieme unico di sfide, in particolare riguardo alla selezione dei materiali, alla scalabilità e all’assicurazione della qualità (QA). Questi fattori sono critici, poiché i dispositivi devono essere biocompatibili, durevoli e in grado di scalare rapidamente per affrontare la crescente esigenza clinica di alternative viabili ai reni donatori umani.
La selezione dei materiali è al centro delle sfide ingegneristiche. I biomateriali utilizzati devono essere non immunogeni, minimizzare la fibrosi e supportare la funzionalità a lungo termine. Polimeri di grado medico e ceramiche avanzate sono in fase di sviluppo per fornire la necessaria biocompatibilità e resilienza meccanica. Aziende come W. L. Gore & Associates stanno ingegnerizzando membrane in politetrafluoroetilene espanso (ePTFE) per dispositivi medici impiantabili, che stanno anche venendo adattate per l’uso nelle interfacce dei dispositivi di xenotrapianto. Innovazioni nei rivestimenti superficiali e nelle tecnologie di incapsulamento, come quelle di Baxter International Inc., puntano a ridurre l’attivazione immunitaria e l’adesione proteica, migliorando ulteriormente la longevità degli innesti.
La scalabilità rimane una questione significativa, poiché prove cliniche di successo aumentano la domanda di produzione di dispositivi. La bio-manifattura deve garantire coerenza dei lotti, sterilità e conformità normativa su scale più ampie. L’implementazione di linee di produzione modulari e automatizzate, come avanzato da Sartorius AG, sta consentendo alle aziende di aumentare la produzione di bioreattori e sistemi di filtrazione utilizzati sia nella fabbricazione dei dispositivi che nella validazione preclinica. Le tecnologie usa e getta di Sartorius aiutano a mitigare i rischi di contaminazione incrociata e supportano una produzione flessibile—una necessità per il settore in evoluzione del xenotrapianto.
L’assicurazione della qualità è fondamentale, poiché la complessità dei dispositivi di xenotrapianto renale richiede protocolli di test rigorosi. Le agenzie regolatorie stanno iniziando a delineare requisiti specifici per i dispositivi xenogenici, influenzando le strategie di QA in tutta l’industria. Produttori leader di dispositivi come Medtronic plc hanno istituito processi QA multi-livello, tra cui monitoraggio in-process, validazione del prodotto finale e sorveglianza post-marketing. Questi approcci vengono adottati e raffinati per la produzione di dispositivi di xenotrapianto, con un’enfasi sulla tracciabilità e sulle risposte rapide a eventuali anomalie rilevate.
In futuro, si prevede che il settore beneficerà di ulteriori integrazioni della tecnologia del gemello digitale, analisi in tempo reale e manutenzione predittiva basata su IA nelle linee di produzione. Questi progressi probabilmente miglioreranno i rendimenti, ridurranno i costi di produzione e miglioreranno l’affidabilità dei dispositivi di xenotrapianto renale mentre si avvicinano all’adozione clinica mainstream nei prossimi anni.
Panorama Normativo: FDA, EMA e Approvazioni Internazionali in Evidenza
Il panorama normativo per l’ingegneria dei dispositivi di xenotrapianto renale sta evolvendo rapidamente poiché l’interesse clinico e i progressi tecnologici accelerano. Nel 2025, la Food and Drug Administration (FDA) degli Stati Uniti continua a svolgere un ruolo fondamentale nella definizione dei requisiti per le domande di New Drug Investigational (IND) e di Investigational Device Exemption (IDE) specifiche per il xenotrapianto. Il Centro per la Valutazione e la Ricerca dei Biologici (CBER) della FDA ha fornito indicazioni aggiornate per gli sponsor riguardo ai test preclinici, allo screening dei patogeni e alla caratterizzazione degli animali di origine, enfatizzando rigorose valutazioni del rischio per quanto riguarda la trasmissione del retrovirus endogeno porcino (PERV) e della compatibilità immunologica. Il Piano d’Azione per il Xenotrapianto della FDA prevede protocolli di sorveglianza rigorosi e un follow-up a lungo termine per i ricevitori di dispositivi e organi derivati dal xenotrapianto, riflettendo una posizione cauta ma sempre più favorevole mentre l’ingegneria dei dispositivi matura U.S. Food and Drug Administration.
All’interno dell’Unione Europea, l’Agenzia Europea dei Medicinali (EMA) sovraintende il xenotrapianto nell’ambito del suo framework per i Prodotti Medicinali per Terapie Avanzate (ATMP). Nel 2025, l’EMA richiede che i dispositivi di xenotrapianto renale ingegnerizzati—come i reni bioartificiali con componenti cellulari porcine o sistemi di perfusione integrati—siano soggetti a valutazione sia come dispositivi che come biologici, richiedendo la conformità duale con il Regolamento sui Dispositivi Medici (MDR) e i requisiti ATMP. L’EMA ha avviato discussioni collaborative con i produttori di dispositivi per chiarire le aspettative riguardanti i dati preclinici, la tracciabilità degli animali di origine e il monitoraggio dei ricevitori, mantenendo al contempo l’allineamento con la Direzione Europea per la Qualità dei Medicinali e la Salute (EDQM) per gli standard sui tessuti xenogenici Agenzia Europea dei Medicamenti.
A livello internazionale, l’armonizzazione normativa sta progredendo ma rimane una sfida. Le agenzie in Giappone e Corea del Sud hanno emesso linee guida provvisorie modellate su standard statunitensi ed europei, concentrandosi sulla biocompatibilità dei dispositivi e sui rischi di infezione tra specie. L’International Xenotransplantation Association (IXA) e l’Organizzazione Mondiale della Sanità (OMS) stanno facilitando sforzi di costruzione del consenso per parametri di sicurezza globali, con diversi produttori di dispositivi—come quelli che sviluppano dispositivi di assistenza renale extracorporea—che partecipano attivamente a programmi pilota normativi International Xenotransplantation Association.
Guardando avanti, i prossimi anni vedranno probabilmente le prime autorizzazioni condizionali al mercato o protocolli di accesso espanso per i dispositivi di xenotrapianto renale ingegnerizzati in giurisdizioni selezionate, a condizione di dati robusti sulla sicurezza e sull’efficacia provenienti da sperimentazioni cliniche in corso. Ci si aspetta che le agenzie regolatorie affinino la sorveglianza post-mercato, i requisiti di segnalazione di eventi avversi e i requisiti di registrazione donatore-ricevente in attesa di un’adozione clinica più ampia.
Previsioni di Mercato 2025–2030: Proiezioni di Crescita e Punti Caldi di Opportunità
Il settore dell’ingegneria dei dispositivi di xenotrapianto renale è pronto per una crescita significativa dal 2025 al 2030, guidata dalla necessità urgente di affrontare le carenze di organi e dai continui progressi sia nelle tecnologie di bioingegneria che di compatibilità immunologica. Con il raggiungimento di traguardi clinici in studi preclinici e nelle prime sperimentazioni umane, gli attori dell’industria stanno accelerando gli investimenti in piattaforme di dispositivi progettate per supportare e monitorare i reni xenotrapiantati, in particolare quelli derivati da fonti suine geneticamente modificate.
Entro il 2025, diverse aziende hanno superato la fase di prova del concetto, avviando applicazioni cliniche in fase iniziale e aumentando le capacità produttive per i sistemi di perfusione extracorporea, dispositivi di immunoisolamento e soluzioni di monitoraggio in tempo reale. In particolare, United Therapeutics Corporation (attraverso la sua controllata Revivicor) e e-therapeutics plc stanno avanzando programmi di xenotrapianto di reni suini che necessitano di ingegneria specializzata dei dispositivi per l’impianto chirurgico, il collegamento vascolare e il monitoraggio della funzionalità post-operatoria. Nel frattempo, i leader dei dispositivi medici come Medtronic e Baxter International Inc. stanno perfezionando tecnologie di emodialisi, plasmapheresi e somministrazione immunosoppressiva per supportare le esigenze uniche dei riceventi di xenotrapianto.
Le previsioni per il 2025-2030 indicano un tasso di crescita annuo composto (CAGR) nella fascia media-alta del teen per i dispositivi di supporto al xenotrapianto renale. Questa crescita è supportata dai traguardi normativi anticipati negli Stati Uniti e nell’UE, con le approvazioni dei dispositivi che seguono da vicino i successi delle prove di trapianto. Inoltre, il mercato dovrebbe essere influenzato dall’emergere di tecnologie piattaforma progettate per integrare biosensing in tempo reale (ad es., per la rilevazione precoce del rigetto) e gestione dei dispositivi powered-by AI per una cura personalizzata del paziente. L’evoluzione rapida di rivestimenti di biocompatibilità, superfici anti-trombotiche e sistemi di monitoraggio immunologico a ciclo chiuso sono identificati come punti caldi di opportunità.
- Sistemi di perfusione extracorporea: Aziende come XVIVO Perfusion AB stanno espandendo le loro piattaforme di conservazione degli organi per accomodare reni xenogenici ingegnerizzati, supportando valutazioni ex vivo e trasporto.
- Biosensori e dispositivi di monitoraggio impiantabili: Ci si aspetta un’innovazione accelerata in matrici di biosensori miniaturizzati e continui, con aziende come Bioreactives GmbH e BIOTRONIK SE & Co. KG che investono in tecnologie di monitoraggio impiantabili di nuova generazione.
- Sistemi di immunoisolamento e filtrazione: Startup e attori consolidati stanno sviluppando dispositivi di filtrazione avanzati per controllare le risposte immunitarie dell’ospite e prevenire il rigetto iperacuto, una barriera critica nel xenotrapianto.
Il panorama competitivo nell’ingegneria dei dispositivi di xenotrapianto renale nei prossimi anni sarà definito da collaborazioni tra settori tra pionieri della biotecnologia, produttori di dispositivi e aziende di salute digitale, sbloccando nuovi percorsi clinici ed espandendo segmenti di mercato indirizzabili.
Panorama Competitivo: Partnership, M&A e Trend di Proprietà Intellettuale
Il panorama competitivo nell’ingegneria dei dispositivi di xenotrapianto renale sta evolvendo rapidamente mentre le aziende intensificano le collaborazioni, le acquisizioni strategiche e la ricerca di portafogli robusti di proprietà intellettuale. L’anno 2025 è pronto a vedere una continuazione e accelerazione di queste tendenze, poiché gli stakeholder cercano di affrontare l’acuta carenza globale di reni trapiantabili attraverso soluzioni interspecie, sfruttando in particolare organi suini geneticamente modificati supportati da tecnologie di dispositivo avanzate.
Grandi aziende biotecnologiche e produttori di dispositivi medici stanno entrando in accordi di collaborazione per unire le forze nell’ambito della modifica genetica, dell’immunosoppressione e della miniaturizzazione dei dispositivi. Ad esempio, Eckert & Ziegler ha annunciato partnership con gruppi accademici per co-sviluppare sistemi di perfusione e conservazione specificamente adattati alle esigenze fisiologiche dei reni xenogenici. Parallelamente, l’International Xenotransplantation Association ha favorito consorzi che includono ingegneri di dispositivi, organizzazioni per il prelievo di organi e esperti normativi, miranti a stabilire standard condivisi per le procedure di xenotrapianto assistite da dispositivi.
Le fusioni e le acquisizioni stanno rimodellando il campo competitivo, poiché le aziende di dispositivi consolidate cercano di integrare piattaforme proprietarie di xenotrapianto nei loro portafogli. Alla fine del 2024, Xenothera e OrganOx Limited hanno avviato una joint venture per combinare l’esperienza di Xenothera nell’ingegneria genetica porcina con i dispositivi di perfusione normotermica diOrganOx, mirando a migliorare la vitalità e la funzionalità degli organi trapiantati. Si prevede che tali alleanze proliferino, con le aziende di dispositivi sempre più orientate verso startup biotech specializzate in tecnologie di immunomodulazione e induzione della tolleranza.
Le strategie di proprietà intellettuale (IP) sono anche centrali per il posizionamento competitivo. Le aziende stanno depositando attivamente brevetti su interfacce di dispositivi che monitorano la funzionalità degli organi xenogenici in tempo reale, sistemi automatizzati di somministrazione di farmaci immunosoppressori e meccanismi di feedback a circuito chiuso adattati alle sfide immunologiche uniche del xenotrapianto. Secondo United Therapeutics, l’azienda detiene un crescente numero di brevetti che coprono dispositivi per la conservazione degli organi e tecnologie di monitoraggio, a sostegno dei suoi sforzi per commercializzare soluzioni di xenotrapianto per insufficienza renale.
Guardando al futuro, i prossimi anni vedranno probabilmente un’intensificazione della convergenza tra settori, con aziende di ingegneria dei dispositivi, innovatori biotech e centri accademici che formano alleanze integrate di R&D e commercializzazione. L’armonizzazione normativa e i modelli di innovazione aperta, sostenuti da organizzazioni come la Food & Drug Administration degli Stati Uniti e l’Agenzia Europea dei Medicamenti, sono destinati a stimolare ulteriormente lo sviluppo collaborativo e l’ingresso semplificato nel mercato dei dispositivi di xenotrapianto. Man mano che il settore matura, coloro che dispongono di portafogli IP ampi e difendibili e di robusti network di partnership saranno meglio posizionati per plasmare il futuro del xenotrapianto renale.
Il Futuro dei Dispositivi di Xenotrapianto Renale: Roadmap, Rischi e Innovazioni Emergenti
L’ingegneria dei dispositivi di xenotrapianto renale è in una fase cruciale nel 2025, con progressi accelerati guidati dai progressi nell’ingegneria genetica, miniaturizzazione dei dispositivi e tecnologie integrate di biosensori. Il paesaggio ingegneristico è caratterizzato da collaborazioni multidisciplinari tra aziende biotech, produttori di dispositivi medici e centri di ricerca accademica, tutte miranti ad affrontare le doppie sfide della compatibilità immunologica e della vitalità a lungo termine del trapianto.
Un evento di riferimento all’inizio del 2025 è stata l’inizio di prove precliniche per dispositivi di rene porcino bioingegnerizzati vascolarizzati. Questi studi, guidati da United Therapeutics attraverso la sua controllata di produzione di organi, si concentrano su dispositivi che accoppiano reni porcini modificati geneticamente con sistemi di monitoraggio impiantabili per la rilevazione del rigetto in tempo reale. I dispositivi sfruttano sensori di nuova generazione che monitorano biomarcatori immuni e la funzione microvascolare, consentendo un intervento precoce e un’immunosoppressione adattativa.
Dal lato dell’hardware dei dispositivi, aziende come Abbott Laboratories hanno annunciato collaborazioni con consorzi di xenotrapianto per adattare le loro piattaforme di biosensori, originariamente sviluppate per dispositivi cardiaci, alle esigenze uniche del monitoraggio dei xenotrapianti renali. Questo include l’integrazione di monitoraggio continuo della creatinina e delle citochine, cruciale per la rilevazione precoce dei segni di disfunzione e risposta immunitaria del xenotrapianto.
Parallelamente, OrganX, una startup nata dalla ricerca accademica, ha dimostrato prototipi di bioreattori di perfusione progettati per sostenere i reni porcini geneticamente modificati ex vivo mentre sono collegati a circuiti di feedback specifici per il paziente. Questi sistemi possono simulare ambienti immuni dei riceventi, fornendo dati pre-trapianto inestimabili che alimentano la progettazione dei dispositivi e i modelli di previsione del rischio.
Le vie normative rimangono un collo di bottiglia, ma la Food and Drug Administration (FDA) degli Stati Uniti ha recentemente ampliato il suo Programma per i Dispositivi Innovativi per includere sistemi di monitoraggio per xenotrapianto, incoraggiando iterazioni rapide e feedback clinici. La FDA sta lavorando a stretto contatto con i produttori di dispositivi per sviluppare standard per l’accuratezza dei biosensori integrati, la biocompatibilità e la sicurezza a lungo termine degli impianti.
Guardando avanti, i prossimi anni vedranno probabilmente gli studi clinici sulle prime applicazioni umane di dispositivi di xenotrapianto completamente integrati, combinando organi modificati geneticamente, biosensori impiantabili e piattaforme di monitoraggio remoto. Le prospettive sono promettenti ma non prive di rischi: i fallimenti dell’interfaccia dispositivo-tessuto, la deriva a lungo termine dei sensori e le sfide della scalabilità della produzione per il dispiegamento clinico sono ostacoli chiave. Tuttavia, la convergenza di ingegneria avanzata, supporto normativo e domanda clinica suggerisce che i dispositivi di xenotrapianto renale giocheranno un ruolo centrale nell’affrontare le carenze di organi e nel far avanzare il trapianto di precisione.
Fonti & Riferimenti
- OrganOx
- Nuwellis
- Universal Cells
- Fresenius Medical Care
- World Health Organization
- eGenesis
- Xenothera
- eGenesis
- Revivicor
- United Therapeutics
- Qihan Biotech
- Eledon Pharmaceuticals
- Tandem Bio
- BioConnect
- NYU Langone Health
- W. L. Gore & Associates
- Baxter International Inc.
- Sartorius AG
- Medtronic plc
- European Medicines Agency
- International Xenotransplantation Association
- XVIVO Perfusion AB
- BIOTRONIK SE & Co. KG
- United Therapeutics